Content
- Diferència principal
- Esterificació vs. Saponificació
- Gràfic de comparació
- Què és Esterificació?
- Què és la Saponificació?
- Diferències claus
- Conclusió
Diferència principal
La diferència principal entre l'esterificació i la saponificació és que l'esterificació és responsable de la formació d'un èster a partir d'un alcohol i un àcid carboxílic, mentre que la saponificació és responsable de la distribució dels èsters de nou a l'alcohol i l'àcid carboxílic.
Esterificació vs. Saponificació
Els esters es coneixen com a compostos orgànics, que es componen bàsicament d’àtoms de H, C i O. La presència del grup –COOR demostra que una molècula específica és un èster. A causa de la presència d'àtoms d'oxigen, els èsters es converteixen en compostos polars. També participen en la formació d’enllaços d’hidrogen amb molts altres compostos.
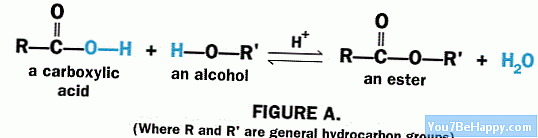
Un èster va aparèixer quan es produeix una reacció entre un àcid carboxílic i un alcohol, i també es fa servir un catalitzador durant la seva formació que és bàsicament un catalitzador àcid. Aquest tipus de formació s’anomena esterificació. El procés, oposat a l'esterificació, es coneix com a saponificació.
El procés d’esterificació té lloc en presència d’un catalitzador encarregat de reduir l’obstacle de l’energia d’activació de la reacció. Aquest catalitzador sol ser un catalitzador àcid. La saponificació, d’altra banda, té lloc en un medi aquós, on també és essencial la presència d’una base. A causa de la presència de les condicions bàsiques del medi, l'anió carboxilat es considera més estable que la forma de l'àcid carboxílic. L'ió carboxilat es desprèn de l'èster per aquest motiu. La barreja de reacció s’ha d’escalfar perquè s’escindeix l’enllaç C-OH de l’àcid carboxílic per eliminar el grup –OH.
El procés d’esterificació necessita energia. Per contra, la saponificació no té barrera energètica i, per tant, pot produir-se sense energia calorífica. En aquesta reacció, les molècules d’aigua del medi aquós ofereixen H+ ions per a la formació d'alcohol i la base ofereix OH– ions necessaris per a la formació d’àcid carboxílic.
Gràfic de comparació
| Esterificació | Saponificació |
| L’esterificació és un procés responsable de la formació d’un èster a partir d’un alcohol i un àcid carboxílic. | La saponificació és un procés responsable de la distribució d’èsters a l’alcohol i l’àcid carboxílic. |
| Tipus de reacció | |
| L’esterificació és una reacció endavant. | La saponificació és una reacció endarrerida. |
| Reactants | |
| Els reactants d’aquest procés són l’àcid carboxílic i un alcohol. | Els reactants d’aquest procés són l’aigua, una base i un èster. |
| Productes | |
| Els productes finals del procés d’esterificació són l’aigua i l’ester. | Els productes finals del procés de saponificació són l’alcohol i l’ió carboxilat. |
| Catalitzador | |
| El catalitzador que s’utilitza en el procés d’esterificació és un àcid. | El catalitzador, que s'utilitza en el procés de saponificació és una base. |
| Energia | |
| L’esterificació requereix energia, que es proporciona en forma de calor. | No es necessita cap energia externa durant el procés de saponificació. |
Què és Esterificació?
L'esterificació és aquell procés responsable de la formació d'un èster a partir d'un alcohol i un àcid carboxílic. La reacció també necessita un catalitzador per disminuir el problema d’energia d’activació de la reacció i el catalitzador ha de ser un catalitzador àcid. Aquest procés necessita energia.
Per eliminar el grup –OH, la barreja de reacció requereix calor per escindir l’enllaç C-OH de l’àcid carboxílic. La reacció té lloc quan s'elimina el protó del grup -OH d'alcohol i el grup -OH de l'àcid carboxílic. Després, el nucleòfil alcohòlic i el catió carboxílic reaccionen entre ells i formen l’èster.
Els productes secundaris d’aquesta reacció són les molècules d’aigua. El protó que havíem tret de l’alcohol reacciona amb el grup –OH, que al seu torn va ser tret de l’àcid carboxílic, per tant, forma una molècula d’aigua.
Es pot obtenir èster pur mitjançant l’addició d’un agent deshidratant. S’afegeix un excés d’alcohol per obtenir un alt rendiment d’èster. També podem utilitzar un agent deshidratant que pugui eliminar l’aigua que es va produir en aquesta reacció. També podem utilitzar altres mètodes per eliminar l’aigua com la destil·lació.
Què és la Saponificació?
La saponificació és aquell procés responsable de la distribució d’èsters a l’alcohol i l’àcid carboxílic. Els reactants que s’utilitzen per dur a terme aquest procés són l’àcid carboxílic i un alcohol. El catalitzador que s’utilitza en aquest tipus de processos és una base. El procés de saponificació no requereix energia.
En aquest procés, l'OS de la base ataca el àtom de carboni de l'enllaç –COO- a l'èster. A causa de la presència de dos àtoms d'oxigen, els dos costats de l'àtom de carboni es carreguen parcialment positivament. Per aquest motiu, es considera un objectiu fàcil per a un nucleòfil. Després d'això, es crea un enllaç amb l'àtom de carboni pel grup OH. Aleshores, per tal d’esdevenir estables, es produeix una reordenació. Aquest és el punt en què el grup –OR de l’alcohol s’allibera, que, al seu torn, és l’encarregat de fer l’àcid carboxílic i es considera el grup que surt d’aquesta reacció.
L’àcid carboxílic conseqüent es desprotona perquè el ió carboxilat es considera més estable en el medi bàsic. El grup –OR es reserva el protó eliminat per formar alcohol.
Diferències claus
- L'esterificació és aquell procés que és responsable de la formació d'un èster a partir d'un alcohol i un àcid carboxílic, mentre que, la saponificació és aquell procés responsable de la distribució dels èsters a l'alcohol i l'àcid carboxílic.
- L’esterificació és una reacció endavant; en canvi, la saponificació és una reacció endarrerida.
- L’esterificació és aquell tipus de procés que requereix energia i l’energia es proporciona en forma de calor. Per contra, la saponificació és aquell tipus de procés que no necessita energia externa.
- Els reactants que s’utilitzen en el procés d’esterificació són l’àcid carboxílic i un alcohol, d’altra banda, els reactius que s’utilitzen en el procés de saponificació són l’aigua, una base i un èster.
- Els productes finals que s’obtenen mitjançant el procés d’esterificació són l’aigua i l’èster, a la cara de l’interior, els productes finals que s’obtenen mitjançant el procés de saponificació són l’alcohol i l’ió carboxilat.
- El catalitzador que utilitzem en el procés d’esterificació és un àcid, per l’altra banda, el catalitzador que utilitzem en el procés de saponificació és una base.
Conclusió
La discussió anterior resumeix que la saponificació és un procés contrari a l'esterificació. L’esterificació està implicada en la síntesi d’èsters, mentre que, la saponificació és el desglossament de l’enllaç èster. El primer necessita energia per aconseguir-ho, mentre que el segon no necessita energia.